近日,三亿体育谢金兵教授团队在国际权威学术期刊Journal of Controlled Release(影响因子11.5)在线发表题为 “Enhancing TIM-3 Immunotherapy with Epirubicin-Loaded pH-Sensitive Fusion Membrane Nanoparticles for Effective Glioblastoma Treatment”的研究论文。该研究构建了一种能够高效穿越血脑屏障并精准递送免疫药物的多功能仿生融合膜纳米体系,在胶质母细胞瘤(GBM)免疫治疗中取得了重要突破,为TIM-3免疫治疗提供了全新的思路。

胶质母细胞瘤是中枢神经系统最具侵袭性和致死性的肿瘤之一,其复杂的免疫抑制微环境及血脑屏障的双重限制,使传统免疫检查点治疗效果有限。TIM-3虽被认为是潜在免疫靶点,但因临床疗效不佳长期被视为“次优靶点”。针对这一难题,谢金兵团队提出“递送系统+免疫原性细胞死亡(ICD)诱导协同”的新策略,开发了pH敏感巨噬细胞膜融合纳米颗粒(A2-TELM),可同时递送抗TIM-3单抗与化疗药物表柔比星(EPI)。该体系通过Angiopep-2肽介导的受体转运高效跨越血脑屏障,实现药物在脑瘤组织的精准富集与酸性环境响应释放。
研究发现,A2-TELM能在脑瘤局部触发肿瘤细胞免疫原性死亡,促进树突状细胞成熟和巨噬细胞M1极化,显著增强CD8⁺细胞毒性T细胞浸润,同时抑制免疫抑制性Treg细胞。该体系在多个胶质瘤动物模型中均表现出显著的肿瘤抑制作用,并诱导形成长期免疫记忆。相比传统的PD-1抗体联合化疗策略,TIM-3阻断与ICD诱导协同可激活更强的先天与适应性免疫反应,显著改善治疗效果。正如论文中指出的那样:“TIM-3曾被认为是疗效受限的次优靶点,但我们的研究表明,通过合理的药物递送和ICD协同治疗,可以完全释放TIM-3的免疫治疗潜能。这一发现为TIM-3免疫治疗开辟了新的方向,并凸显了递送系统在突破胶质瘤复杂免疫抑制环境中的关键作用。”
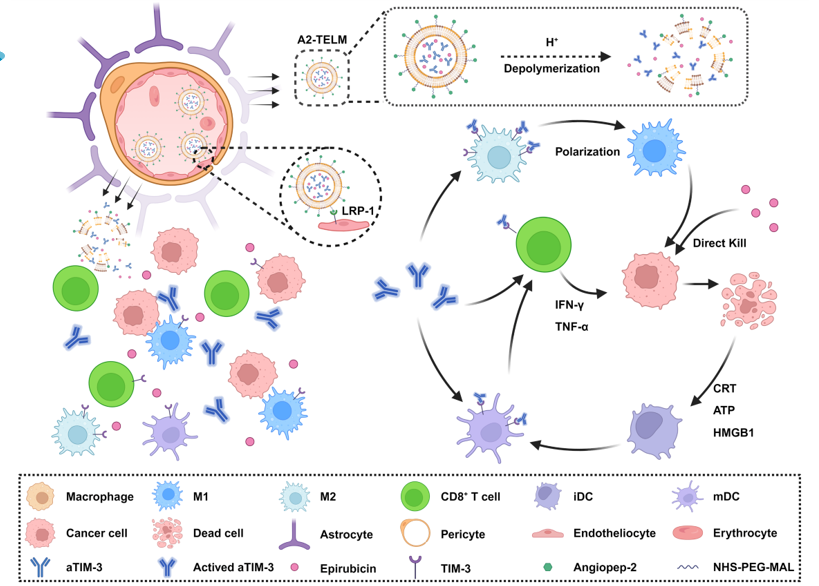
该研究不仅揭示了TIM-3靶点重新激活的分子机制,也展示了pH敏感仿生融合膜纳米颗粒递送系统在脑肿瘤精准治疗中的巨大潜力。该纳米颗粒通过融合巨噬细胞膜与酸敏脂质体,实现药物的靶向递送与环境响应释放,兼顾了高效穿透性与免疫激活能力。通过化疗诱导免疫原性死亡与免疫检查点阻断的有机结合,研究团队提供了一种兼顾靶向性与免疫活性的全新治疗模式,为脑胶质瘤及其他免疫耐受性实体瘤的精准免疫治疗提供了重要参考。
医三亿体育(中国)硕士毕业生朱丹琪,副研究员朱旖旎及博士研究生杨旭宏为共同第一作者,谢金兵教授与顾小春副教授为共同通讯作者。该研究获得国家自然科学基金(82372023、82172010)、国家自然科学基金青年项目(82403285)及国家重点研发计划(2022YFE0116700)资助。
原文链接:https://authors.elsevier.com/sd/article/S0168-3659(25)00981-2

 搜索
搜索